Dysfunkce arteriovenózní fistule a její včasné řešení prodlužuje životnost fistule
Souhrn
Kvalitní arteriovenózní fistule (AVF) zajistí efektivní hemodialýzu (HD) a musí být dialyzačním týmem pečlivě monitorována, nejlépe prostřednictvím tzv. klinických indikátorů: fyzikálním vyšetřením (FV) a údaji z dialyzačního monitoru. FV AVF je nezbytné pro její živostnost, a dialyzační tým by je měl proto perfektně ovládat. Guidelines Kidney Disease Outcomes Quality Initiative (KDOQI) doporučují provádět kontroly AVF kvalifikovaným pracovníkem (lékařem nebo sestrou), tzv. supervizorem, jednou za měsíc. FV je velmi efektivní, snadno dostupné, rychle proveditelné. Stejně tak dobře dostupné jsou i údaje z dialyzačního monitoru, jako jsou hodnoty průtoku krve (QB), tlaky na arteriálním a venózním konci kapiláry (tka + tkv), ukazatel dialyzační dávky (Kt/v) a velikost průtoku měřené během HD recirkulací nebo sonograficky. Dysfunkce AVF znamená, že průtok fistulí je buď nízký, a HD je neadekvátní, anebo vysoký, který významně poškozuje srdce a může vést k srdečnímu selhání, eventuálně k úmrtí, pokud není včas řešen. Zlatým standardem trvalého cévního přístupu je nativní AVF (AVFn) s lokalitou na předloktí (RC) nebo na paži (BC, BB). Další volbou je arteriovenózní graft (AVG), nejčastěji obloukovitý zkrat mezi arteria brachialis a vena basilica (eventuálně v. cefalica) pomocí cévní protézy.
Klíčová slova: AVF – high-flow – klinické indikátory – stenóza – trombóza
Úvod
O fyzikální vyšetření arteriovenózní fistule (AVF) je nyní stále větší zájem, ačkoliv by mělo být rutinou před každou hemodialýzou (HD). Je to vyšetření velmi efektivní, snadno dostupné, levné, rychle proveditelné a upozorní na dysfunkci průtoku, a je tedy „prevencí“ dalších možných komplikací. AVF by měla být funkční po celou dobu dialyzačního života pacienta a zajistit dostatečný průtok krve a snadnou punkci dvěma jehlami. Znalost fyzikálního vyšetření AVF je pro její životnost velmi důležitá a dialyzační tým musí vyšetření perfektně ovládat. V doporučeních Kidney Disease Outcomes Quality Initiative (KDOQI) (2019) se uvádí týmová péče o pacientův cévní přístup (CP) s označením „Life Plan“; tento tým by měl fungovat ve složení nefrolog, cévní chirurg, sonografista a invazivní radiolog, kteří se podílejí na řešení komplikací AVF během HD léčby pacienta.1
Fyzikální vyšetření AVF
Fyzikální vyšetření (FV) AVF je v posledních letech středem zájmu v doporučeních jak KDOQI, tak evropských European Renal Best Practice Guideline (ERBPG),1–4 ačkoliv by mělo být rutinou před každou HD. Znalost fyzikálního vyšetření AVF spočívá ve 3P – pohledem, pohmatem a poslechem celé oblasti AVF.5,6
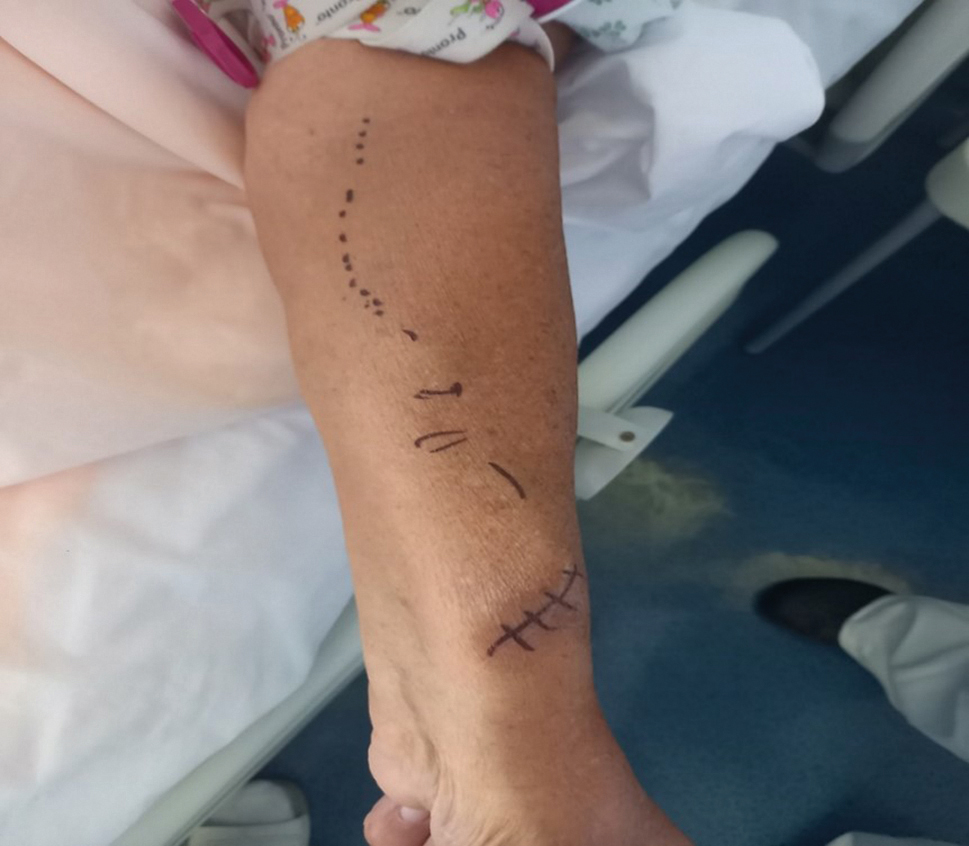
- Pohledem na celou plochu AVF (celou horní končetinu od prstů až na hrudník) a takto vypadá optimální stav (1A, 1B)– kůže je čistá, žíla je naplněná v celé délce a jizvy zhojené. Pohledem vylučujeme hematomy (obr. 2), otok ruky se stenózou ve výtokové části („outflow“) (obr. 3). Na dalším obrázku je aneurysma se stenózou outflow (obr. 4). Ne každé aneurysma má stenózu a rozlišit nám to pomůže elevační test (obr. 5). Infekce se projevuje zarudnutím, vyklenutím, bolestí v místě vpichu se sekrecí (obr. 6). V oblasti žilní části nativní AVF (AVFn) můžeme vidět kolaterální žíly i na hrudníku, což je známkou obstrukce průtoku. Všímáme si případné změny barvy prstů, zda nejsou bílé či cyanotické a zda nejsou vidět gangrenózní ložiska (obr. 7).
- Pohmatem AVFn je žíla normálně snadno stlačitelná (měkká) a pulsace jsou dobře hmatné jedním až dvěma prsty (8A). Je‑li stenóza kdekoliv v žilní části, lze pohmatem prstem pod stenózou detekovat hyperpulsace („chtějí překonat překážku“) (obr. 8B). Chceme‑li zjistit, zda není stenóza jen v místě anastomózy, provedeme rozšířený palpační test (pulse augmentation test) (obr. 9). Dalším vyšetřením jsou „vibrace“ (viz obr. 10A, 10B).
Zjistíme‑li rezistenci v oblasti AVF, nejspíše hematom, uvedeme velikost: zakreslíme, změříme nebo přirovnáme např. k ovoci (švestka, meruňka…). - Poslechem AVF vyšetřujeme vždy s fonendoskopem a pátráme po změně síly šelestu – jeho hlučnosti. Nejhlučnější je nad anastomózou a s délkou slábne, pokud je v celém dalším úseku bez stenózy. Pokud je stenóza v místě anastomózy, je šelest slabý, až zcela zanikne. Stenotické zúžení v žilní části u AVFn vede naopak k zesílení šelestu pod překážkou stejně jako u začínající stenózy arteriovenózního graftu (AVG) v oblasti outflow.
OBR. 1 (A) AVFn radiocefalika – optimální stav před HD
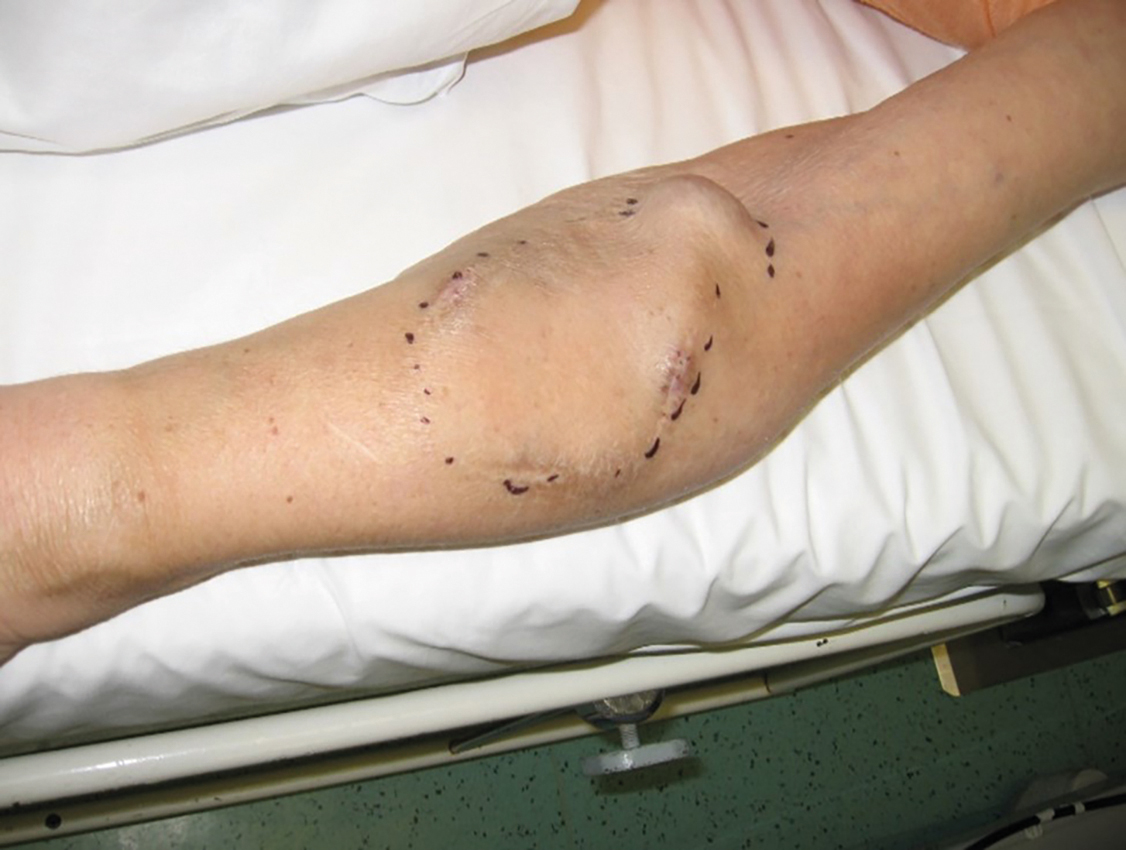
OBR. 1 (B) AVG – obloukovitý graft – optimální stav před HD.
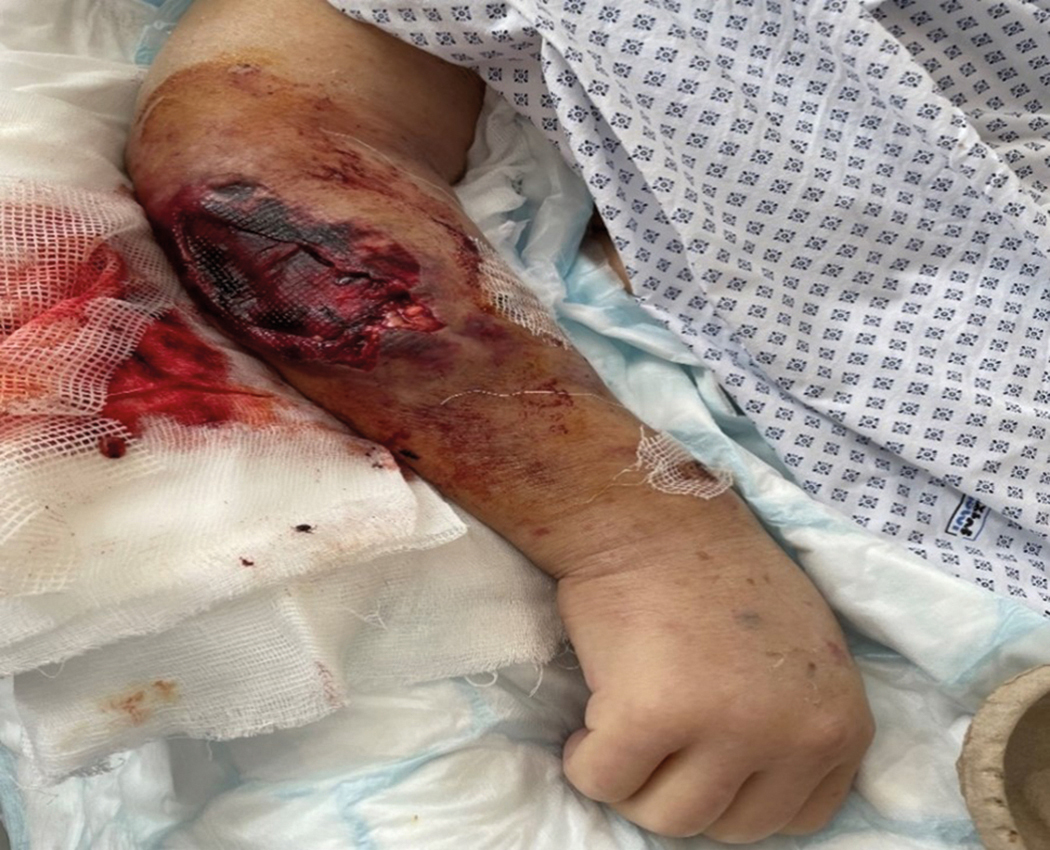
OBR. 2 Rozsáhlý hematom s devastací okolních tkání.
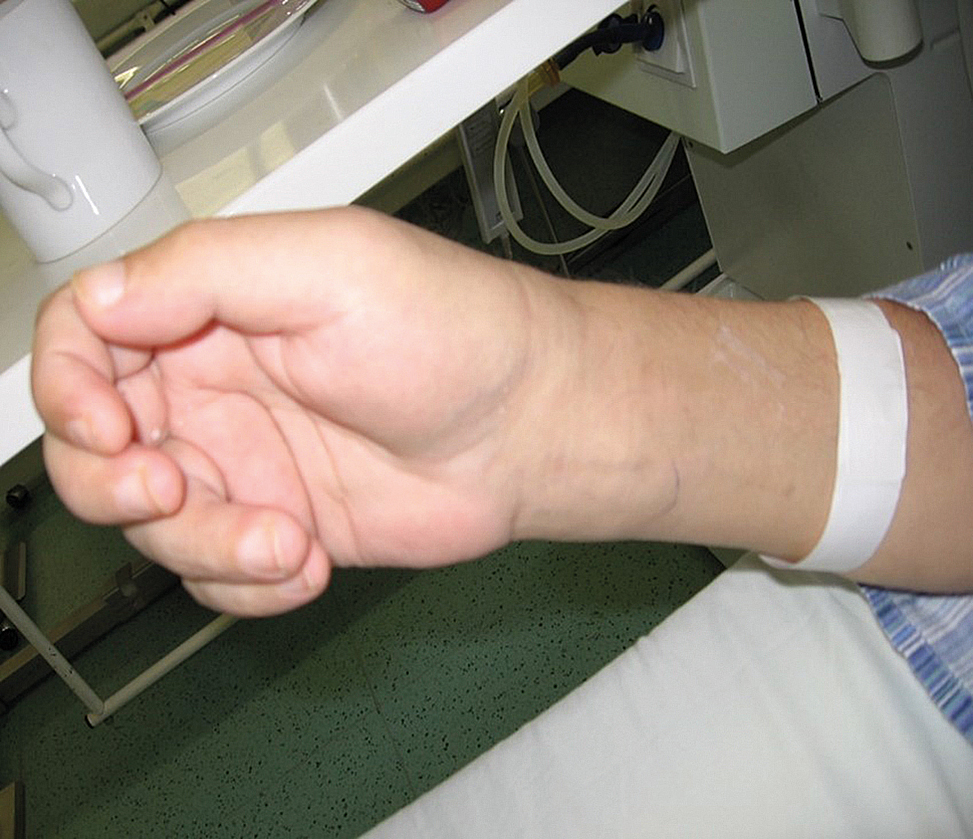
OBR. 3 Otok ruky při stenóze AVG (outflow).
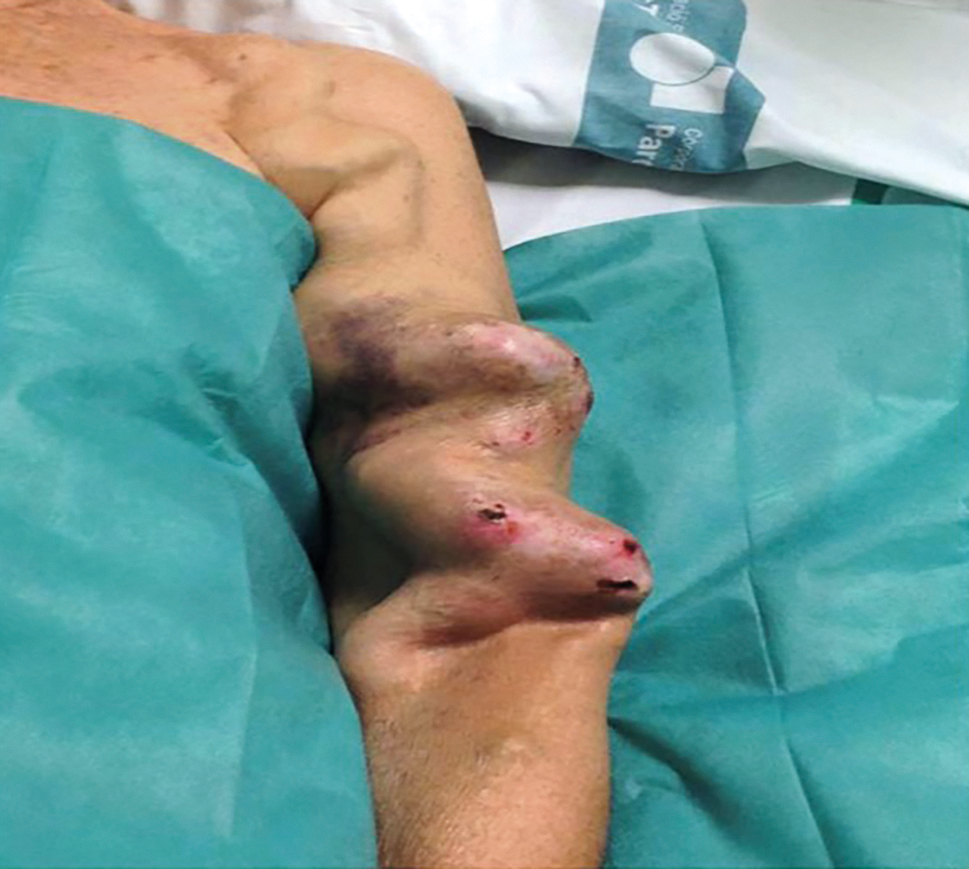
OBR. 4 AVFn s aneurysmatem a stenózou outflow.
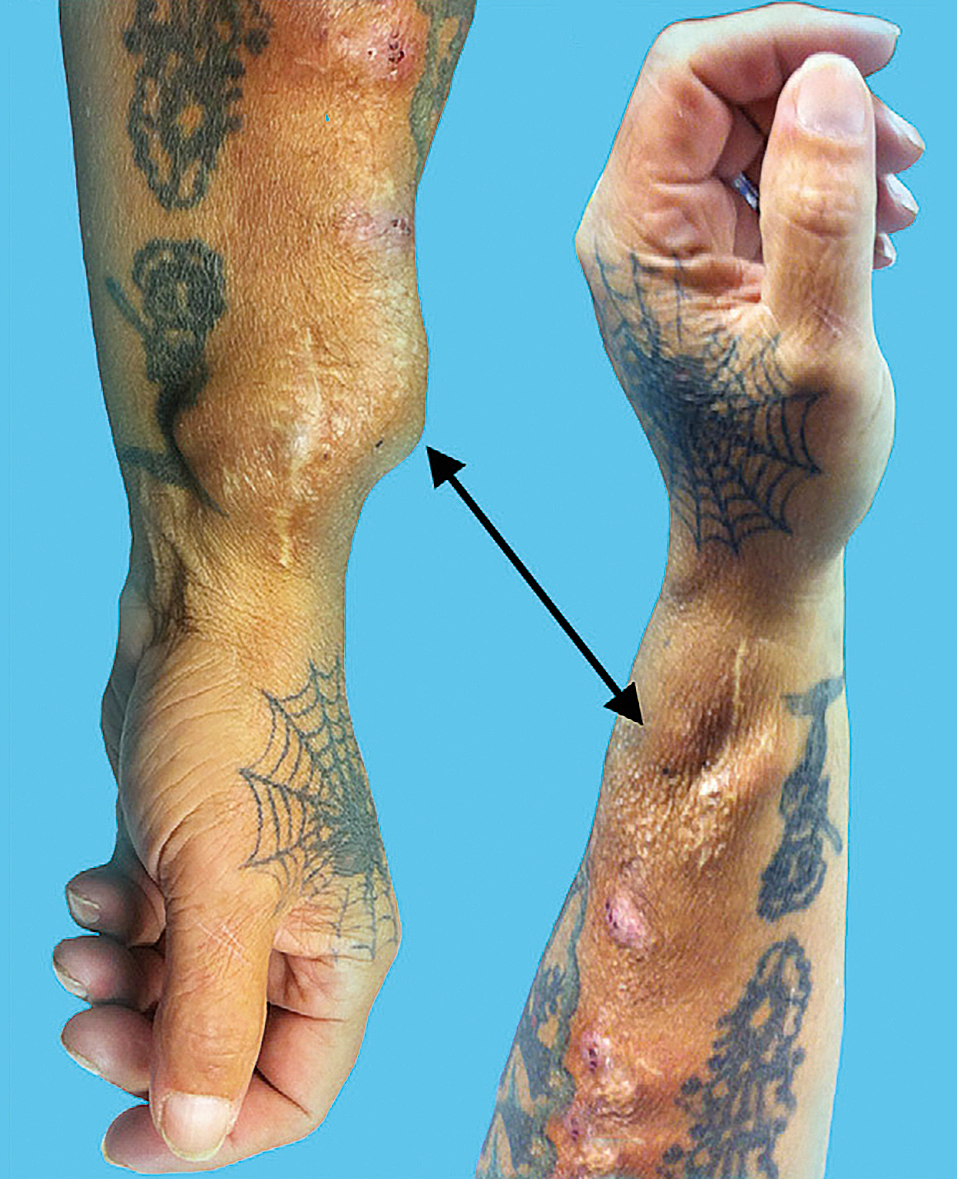
OBR. 5 (A, B) Elevační test negativní (A naplněné aneurysma, B po elevaci horní končetiny vymizí,
výtoková žíla je volná).6
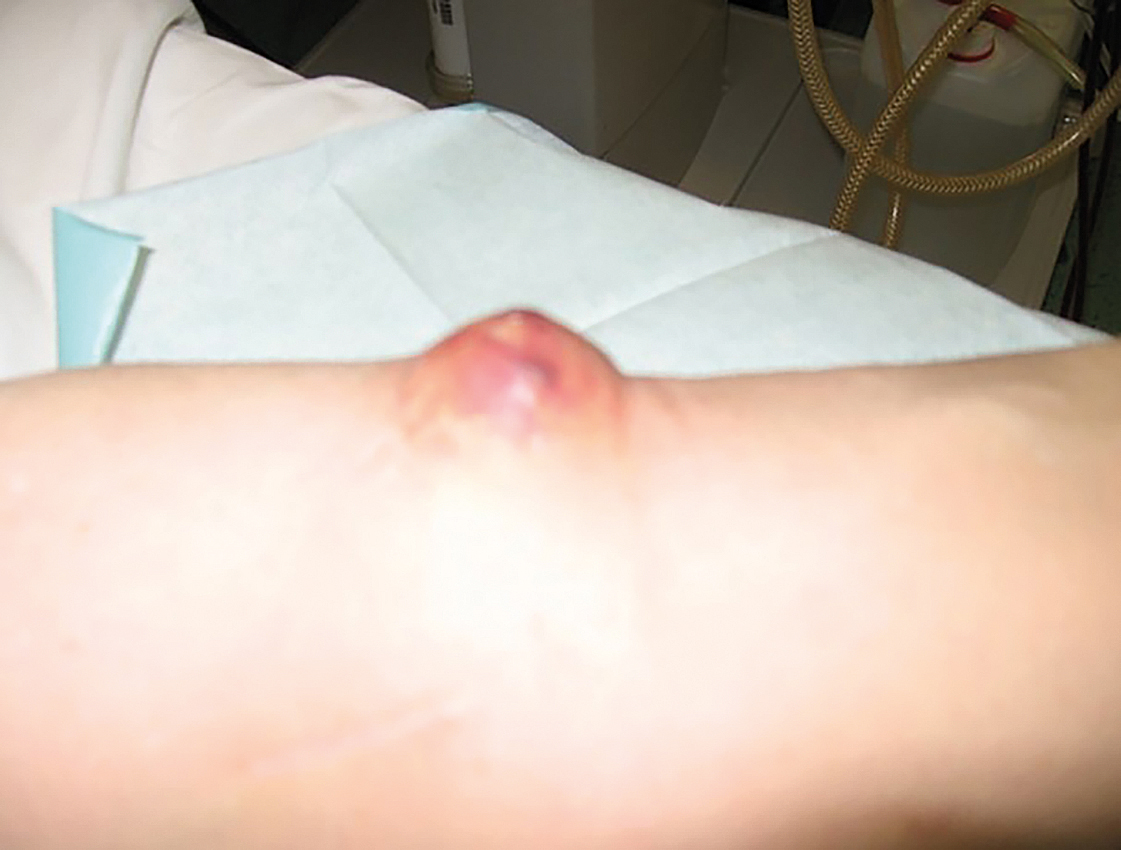
OBR. 6 AVFn s infekčním ložiskem na kůži (knoflíková metoda).
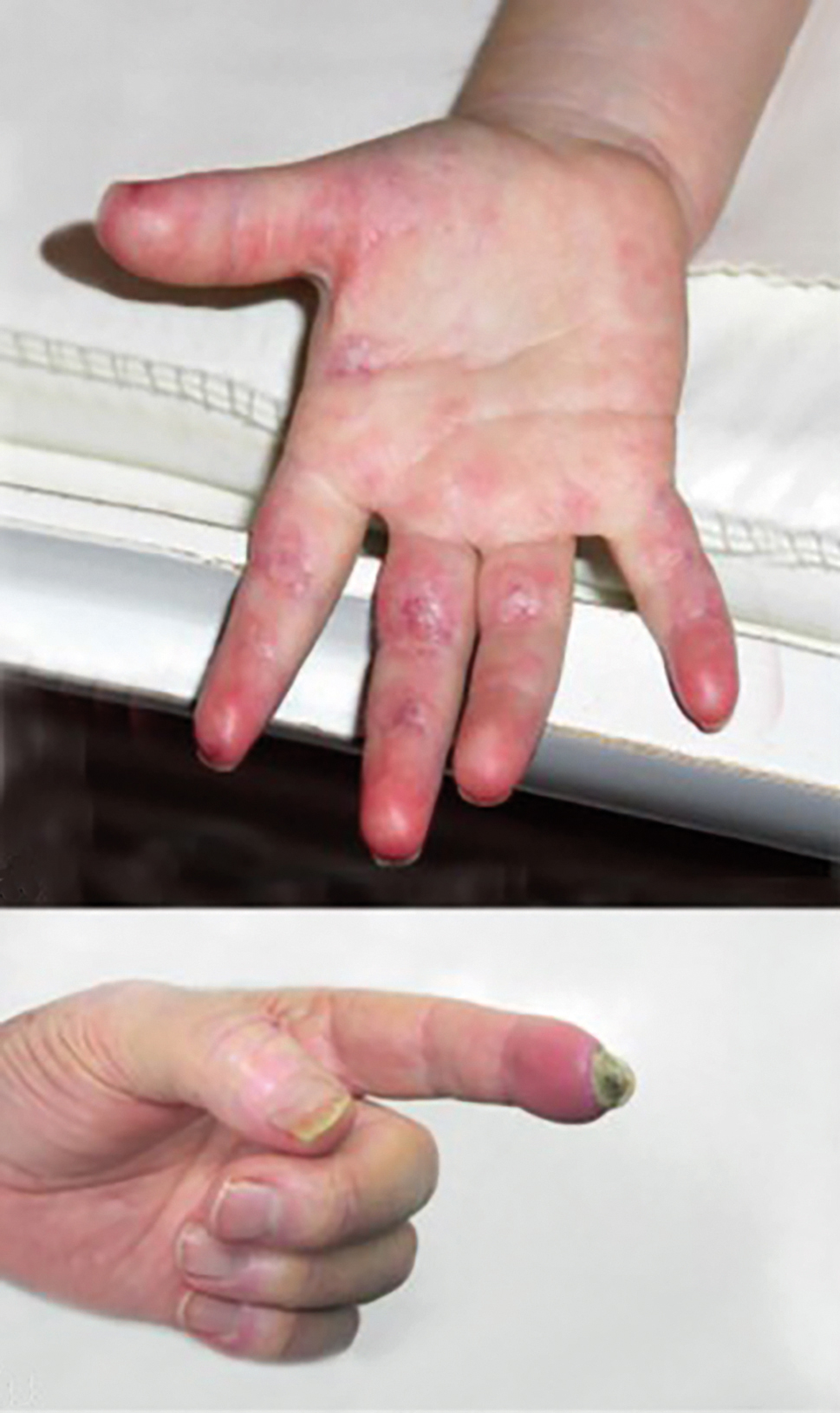
OBR. 7 Barevné změny u steel syndromu a gangrenózní ložisko na špičce prstu.6
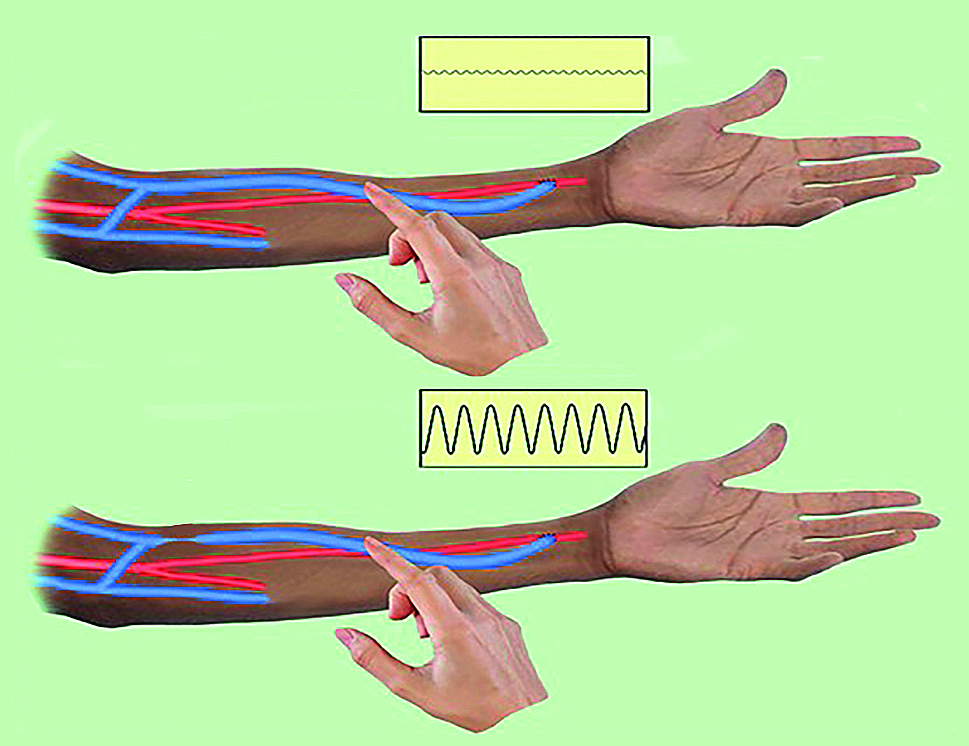
OBR. 8(A) Pohmatem je žilní část měkká, stlačitelná, (B) pohmatem prstem pod stenózou jsou zjistitelné hyperpulsace.6
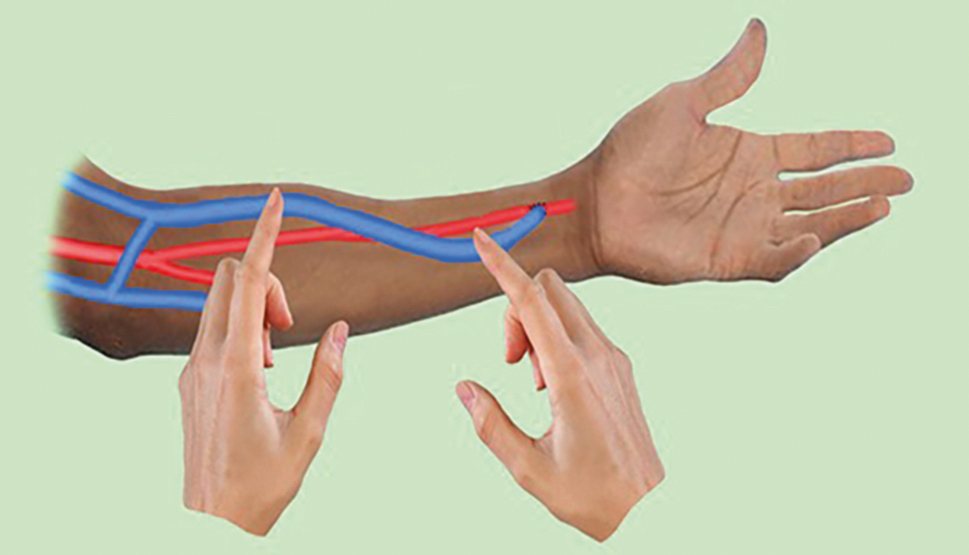
OBR. 9 Rozšířený palpační test (pulse augmentation) k vyloučení stenózy v anastomóze. Kompresi provedeme jedním prstem levé horní končetiny a prstem pravé horní končetiny palpujeme silné pulsace – volná anastomóza anebo slabé pulsace – anastomóza se zavírá.6
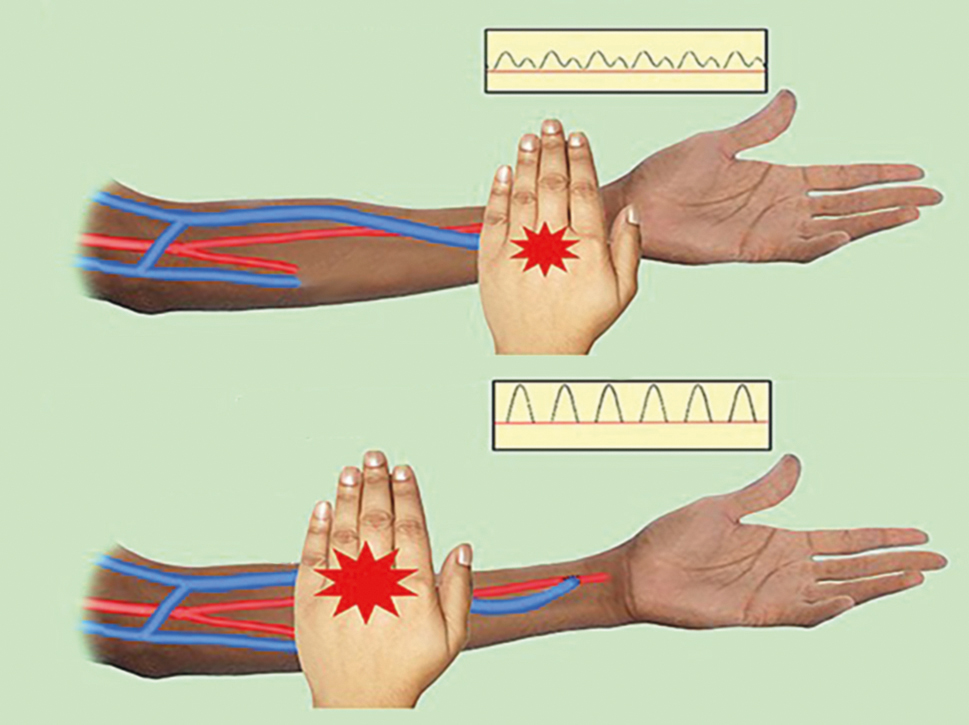
OBR. 10 (A) Vyšetření vibrací AVFn je obdobné jako u vyšetření pulsace a (B) ruka pod stenózou má silnější vibrace pro překonání „překážky“.6
Dysfunkce AVF se dělí podle průtoku do dvou skupin:
- Trombotic flow– stenóza a trombóza AVF v kterékoliv lokalitě, ale nejčastěji je u AVFn v místě anastomózy (výskyt 0,1–0,5/rok) a u AVG v oblasti výtokové části venózního ramene s častější frekvencí (0,5–2,0/rok).
- Non‑trombotic flow – jde o ostatní komplikace AVF – lokální (např. hematomy, infekce aj.) anebo high‑flow AVF s vysokým průtokem fistulí.
Pro dialyzační tým je nezbytná znalost kvality průtoku sledovaného „klinickými indikátory“ (FV 3P + záznamy z dialyzačního monitoru). Každá sestra, než vezme do ruky jehly před HD, si vždy musí prohlédnout celou oblast AVF a jen pohledem může vyloučit některé komplikace již na začátku HD anebo v jejím průběhu sledováním údajů z dialyzačního monitoru.
Stenóza/trombóza AVF7,8 je nejzávažnější komplikací, neboť způsobí její afunkci – zabrání průtoku krve a AVF zaniká. Dobře víme, že ji předchází stenóza a její včasná diagnóza může vzniku trombózy i zabránit. Proč vzniká stenóza/trombóza jen u některých pacientů (často i opakovaně), ale u jiných ani po letech nevznikne nikdy nebo výjimečně? Z literárních statistik vyplývá, že AVG má nejčastější trombózu ve venózním konci anastomózy a AVFn nejčastěji v místě anastomózy a vzácně v kterémkoliv úseku žilní části. Znám pacienty, kteří neměli stenózu AVF ani jednou za dlouhý dialyzační život (> 20 let), a naopak jiné, kteří měli stenózu AVF i několikrát za 20 let (v intervalu tří až šesti měsíců), ale včasně provedená fistulografie indikovaná na podkladě klinických indikátorů zajistila dál její funkci.
Etiologie stenózy/trombózy AVF tvoří soubor faktorů působících v patogenezi žilní trombózy (Virchowova trias): poškození endotelu je multifaktoriální – stres, punkce dialyzačními jehlami, zvýšená produkce cytokinů s následným proliferativním procesem, který vede ke zúžení lumen; stáza (nejčastěji u hypotenzních stavů) a hyperkoagulační stavy. Ty mohou být vrozené – nejčastěji mutace f. V Leiden nebo genu pro protrombin, ale často sami dialyzovaní pacienti jsou v protrombogenním stavu (zvýšené koncentrace C‑reaktivního proteinu [CRP], nízké hodnoty albuminu, zvýšené hodnoty homocysteinu aj.).
Prevence stenózy/trombózy spočívá ve využití klinických indikátorů, tj. ve znalosti fyzikálního vyšetření (viz výše) a vyhodnocení záznamu z dialyzačního monitoru během HD (hodnoty tlaků na arteriálním a venózním konci kapiláry [tka + tkv], ukazatel dialyzační dávky [Kt/V] a četnosti alarmů). Pravidelné vyšetření velikosti průtoku AVF během HD metodou recirkulace (R %)9 může odhalit stenózu v jejím začátku a při dalších vyšetřeních závisí na trendu naměřených hodnot a současně i na vývoji klinických indikátorů. Je‑li hodnota R > 20 %, existuje vždy podezření ze stenózy a je vhodné toto vyšetření zopakovat. V různých doporučeních jsou udávány odlišné intervaly jeden až tři měsíce; v našem středisku je provádíme u AVFn jednou za tři měsíce, u AVG jednou za dva měsíce, ale současně si všímáme i ostatních nálezů klinických indikátorů. Při nejasných nálezech R doporučíme i sonografické vyšetření.
Manifestací stenózy/trombózy u AVFn je nejčastěji stenóza v místě anastomózy a v době zrání, v žilní části bývá stenóza v krátkém úseku a výjimečně pokračuje v celé délce až do centrální žíly. Někdy se mohou objevit u krátké stenózy žilní kolaterály (tzv. nová cesta v průtoku). Nad stenózou se mohou objevit i příznaky tromboflebitidy (pohmatem tužší bolestivé zarudnutí, eventuálně měkký otok okolí). U AVG je stenóza lokalizována ve venózní žilní části a nejčastěji v místě u výtokové anastomózy. První známkou jsou nárůst tkv i při stabilním průtoku při HD a opakované alarmy během HD. FV zjistíme pod venózní anastomózou změnu pulsace i hlučnost šelestu, které sílí. Včasně nepoznaná stenóza přejde do trombózy a může postupovat celým graftem až do arteriální části a vyústit v uzávěr i arteriální anastomózy, a tím zrušit cévní přístup. Tromboflebitida se u AVG nevyskytuje, ale pokud se objeví nad graftem v malém úseku zarudnutí i bolest, jde jen o překrývající infekci v této oblasti a následnou druhotnou trombózu. V tabulce 1 uvádíme v přehledu u stenóz AVFn a AVG patologické nálezy z FV i jiné abnormality.
Definitivní doporučení řešení stenózy záleží jen na dialyzačním lékaři, který zhodnotí výše uvedené klinické indikátory a doporučí vyšetření invazivním radiologem nebo cévním chirurgem. Při nejistotě diagnózy doporučí duplexní sonografii10 jako nástroj dohledu nad klinickými indikátory. Názory na provedení fistulografie dle KDOQI1 (kapitola 13)5–7,9 mohou být někdy i překvapující jak u AVF, tak u AVG.
Jaké jsou možnosti řešení stenózy/trombózy?
- Odhalit včas stenózu AVF dialyzačním personálem; před každou HD orientačním FV vyšetřením sestrou a ze záznamu minulé HD vyhodnotí dialyzační lékař další postup dle četnosti alarmů, hodnot tka + tkv, Kt/v,QB aj.
- Zvážit supervizora (dialyzační lékař nebo dialyzační sestra), jak se uvádí i v KDOQI,1 který jednou měsíčně zhodnotí kvalitu AVF: FV + záznamy z dialyzačního monitoru včetně kontroly měsíčních laboratorních hodnot. Ze svého hodnocení doporučí případnou jinou taktiku kanylace jehel (zejména u aneurysmat), zhodnotí čas komprese po odstranění jehel, indikuje zopakování vyšetření průtoku R během HD nebo vyšetření duplexní sonografií.
- Dialyzační lékař musí definitivně rozhodnout o dalším postupu – u zjištěných stenóz AVF předáním dalším odborníkům týmu Life – intervenčnímu radiologovi nebo cévnímu chirurgovi. Podobně je tomu u trombózy:
- Intervenční radiolog provede trombektomii (mechanickou nebo farmakologickou nebo kombinací obou metod) a vždy s následnou fistulografií, eventuálně angioplastikou či implantací stentu.
- Cévní chirurg provádí většinu trombektomií u AVFn při uzávěru zejména v pooperační době. U AVG při opakovaných uzávěrech nebo u torpidních stenóz se provádí tzv. hybridní procedura – chirurgická trombektomie a fistulografie s intervencí na operačním sále.
Dysfunkce non‑trombotic flow = high‑flow AVFn je vysokoprůtoková fistule, kterou definujeme jako velikost průtoku (Qa) vyšetřeného sonograficky: > 1 500 ml/min (radiocefalická AVF), > 1 700 ml/min (AVF Gracz) anebo ze srdečního výdeje (CO) zjištěného z echokardiografického vyšetření; pro vysokoprůtokovou AVF platí vztah, že Qa je > 20 % celkového CO.11,12 Žilní část u radiocefalické AVF se při velkém průtoku má tendenci aneurysmaticky remodelovat (tj. šíře > 18 mm) nebo se objevuje výrazná žilní kresba v okolí AVF nebo na hrudníku a při současné stenóze v centrálním řečišti i otok ruky. Je důležité znát šíři anastomózy buď z operačního protokolu, anebo z duplexní sonografie. Rizikoví jsou pacienti s kardiologickou anamnézou a se širokou arteriovenózní anastomózou. Mezi klinické projevy velkého průtoku patří vysoký CO, excentrická hypertrofie levé komory srdeční, myokardiální ischemie, pulmonální hypertenze a nakonec pravostranné srdeční selhání. U vysokých hodnot průtoku je nutné měřit průtok v pravidelných intervalech (tři měsíce metodou R) a dle vzestupného trendu i sonograficky společně s echokardiografickým vyšetřením.
Terapie redukce cévního přístupu je v rukou cévního chirurga: bandage (zúžení), nová anastomóza, aneurysmorafie a ligace většinou jen z vitální indikace.13
Další, ale vzácnou komplikací velkého průtoku AVF je HAIDI (hemodialysis access‑induced distal ischemia) – „steal“ syndrom.14 Rizikoví pacienti jsou diabetici anebo pacienti s mediokalcinózou. První příznaky se projevují pocity studených prstů, hypestezií a klidovými bolestmi, které začínají již při zahájení HD a rychle nabírají na intenzitě. Řešení patří cévnímu chirurgovi, většinou je třeba provést ligaci dříve, než vznikne gangréna prstů (obr. 11).
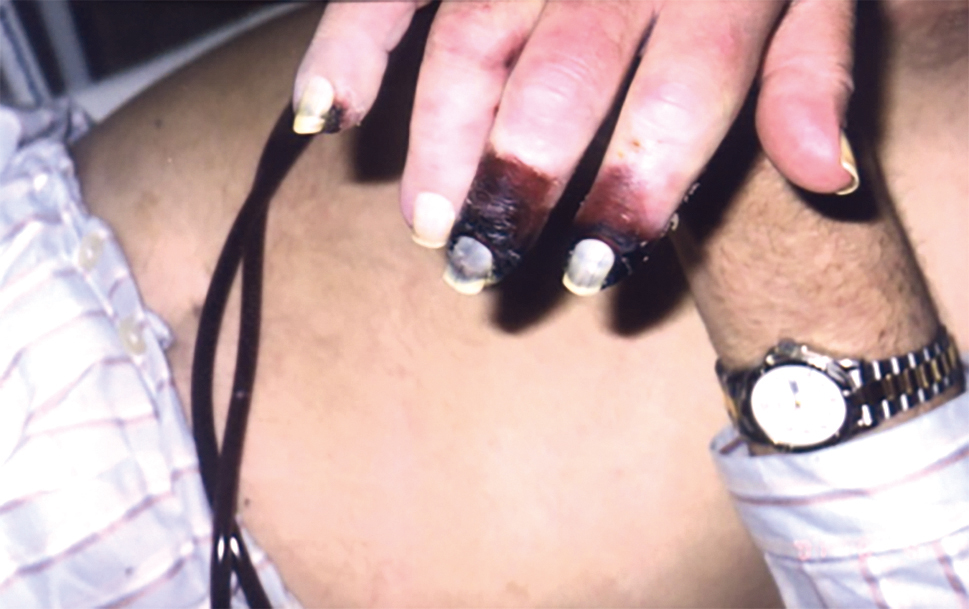
OBR. 11 Pokročilá gangréna prstů u steel syndromu.
Závěr
Dysfunkce trombotic flow (stenóza a trombóza) AVF zkracují významně živostnost AVF, nebo dokonce způsobí zánik AVF. Je důležité znát výhodu klinických indikátorů, které mohou včas detekovat stenózu/trombózu AVF, a dialyzační tým by je měl proto perfektně ovládat a se spolupracovníky z týmu Life najít optimální řešení. Dysfunkce non‑trombotic flow spojené s high‑flow vede k srdečnímu poškození a je nutné pravidelné monitorování průtoku i echokardiografické vyšetření. A o řešení by měl rozhodnout cévní chirurg v úzké spolupráci s dialyzačním lékařem a kardiologem.
Literatura
- KDOQI 2019 Clinical practice guideline for vascular acces (guideline 13.–15., s. 80–98).
- Lok CE, Huber TS, Lee T, et al. KDOQI Clinical Practice Guideline for Vascular Access: 2019 Update. Am J Kidney Dis 2020;75(4 Suppl. 2):S1–S164.
- Schmidli J, Widmer MK, Basile C, et al. Editors Choice – Vascular Access 2018: Clinical Practice Guidelines of The European Society for Vascular Surgery. Eur J Vasc Endovasc Surg 2018;55:757–818.
- Vanholder R, Biesen WV, Fox JG, et al. The new European Renal Best Practice guideline on arteriovenous access: why worthwhile to read. Nephrol Dial Transplant 2019;34:1071–1074.
- Beathard GA, Dillavou ED, Collin K. UpToDate Physical examination of the mature hemodialysis arteriovenous fistula. Dostupný z: https://medilib.ir/uptodate/show/1924. Naštíveno: 29. 2. 2024.
- Salman L, Beathard G. Physical Examination as a Tool for Surveillance for Hemodialysis Arteriovenous Access. Clin J Am Soc Nephrol 2013;8:1220–1227.
- Quencer KB, Oklu R. Hemodialysis access thrombosis. Cardiovasc Diagn Ther 2017;7(Suppl 3):S299–S308.
- MacRae JM, Dipchand CH, Oliver M, et al. Arteriovenous Access, Failure, Stenosis and Trombosis. Can J Kidney Health Dis 2016;3:2054358116669126.
- Lopot F, Malík J, Švára F, Polakovič V. Techniky měření recirkulace a průtoku krve cévním přístupem pro hemodialýzu. Aktual v Nefrol 2019;25:13–27.
- Chytilová E, et al. Cévní přístup pro hemodialýzu. Praha: Maxdorf, 2023;273–276.
- Beathard GA, Dillavou ED, Collin K. High‑flow hemodialysis arteriovenous access. UpToDate, May 26/2022.
- Válek M, Lopot F, Polakovič V. Arteriovenous fistula, blood flow, cardiac output and left ventricle load in hemodialysis patients. ASAIO J 2010;56:200–203.
- Baláž P. Aneurysma AVF – kdy a jak léčit. Postgrad Nefrol 2021;19:7–8.
- Leake AE, Winger DG, Leers SA, et al. Management and outcomes of dialysis access associated steel syndrome. J Vasc Surg 2015;61: 754–760.
- Kategorie: Názor hosta
- Klíčová slova: AVF; high-flow; klinické indikátory; stenóza; tromboembolické komplikace
